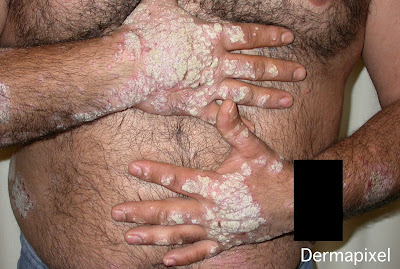
El hígado graso no alcohólico (HGNA) es una enfermedad producida por el depósito de grasa en el hígado en ausencia de un consumo significativo de alcohol, medicamentos esteatogénicos o determinadas enfermedades hereditarias y a día de hoy nadie discute su asociación con la psoriasis, siendo considerado como una de las principales comorbilidades de la enfermedad psoriásica, junto al síndrome metabólico, la hipertensión arterial, la obesidad, la dislipemia y la resistencia a la insulina. Y es especialmente relevante porque actualmente es la primera causa de hepatopatía en el mundo occidental y se considera que un 20% de la población adulta padece HGNA. Todo ello se acentúa en presencia de síndrome metabólico y el 38% de personas con sobrepeso, el 46% de los obesos, el 65% de los casos de obesidad grave y el 90% de los pacientes con obesidad mórbida tienen HGNA. En diabéticos la prevalencia de HGNA es del 69% y en pacientes con hipertrigliceridemia, del 50%.
Histológicamente se distinguen dos formas: la esteatosis, en la que existe un depósito de grasa pero sin daño hepatocitario y la esteatohepatitis, en la que además existe daño hepatocitario con inflamación y, eventualmente, fibrosis. Un 15-25% de los pacientes con esteatohepatitis habrán evolucionado a cirrosis en 10 años, con sus potenciales complicaciones. insuficiencia hepática, varices esofágicas o hepatocarcinoma, que conducirán a la muerte del 25% de los pacientes en esa fase en 5 años. Actualmente es la segunda causa de trasplante hepático en Estados Unidos y va camino de convertirse en la primera.
La relación de la enfermedad psoriásica con el HGNA es evidente. El hecho ser dos patologías que además tienen en común una alta frecuencia de síndrome metabólico y de resistencia a la insulina hacen que la liberación de adipoquinas proinflamatorias conduzca a una cierta inflamación lo que conlleva un círculo vicioso difícil de romper que conduce al daño hepático, pero que además también influye en la progresión de la psoriasis. Así, los pacientes con psoriasis tienen un riesgo incrementado de HGNA (OR 2.15), pero es que además los pacientes con psoriasis que tienen HGNA tienen formas más graves de psoriasis, siendo el HGNA un predictor significativo de valores elevados de PASI en estos pacientes independientemente de sus otros factores de riesgo.

En definitiva, el tejido adiposo actúa como un verdadero órgano endocrino, produciendo adipocitoquinas o adipoquinas. Estas incluyen la leptina, adiponectina y resistina, que son importantes en el balance energético y en el metabolismo lipídico y de la glucosa, resistencia a la insulina, tensión arterial y angiogénesis, además de factor de necrosis tumoral (TNF) alfa e interleucina-6. Algunos de estos mediadores juegan un papel dominante en el desarrollo de síndrome metabólico, como los niveles elevados de leptina o una disminución de los niveles de adiponectina. Todo ello, como hemos adelantado, parece influir en la evolución de la enfermedad psoriásica, además del daño hepático. También es curioso comprobar cómo no todos los pacientes con psoriasis e HGNA tienen síndrome metabólico, así que tampoco lo podemos descartar en aquellos pacientes que nos parezca que tengan un bajo riesgo.
Porque aunque parezca todo muy sencillo, en realidad uno de los principales retos del HGNA es realizar un correcto diagnóstico, que por definición se basa en la demostración de la existencia de esteatosis en una biopsia hepática o en pruebas de imagen y en la exclusión de otras causas de enfermedad hepática, consumo significativo de alcohol o desencadenantes específicos. Y es que esta enfermedad está claramente infradiagnosticada debido a que, salvo en formas muy avanzadas, no produce síntomas que permitan sospecharla y porque, desde un punto de vista analítico, se caracteriza por una alteración leve e inespecífica de la bioquímica hepática, que puede incluso mantenerse en límites normales en un 15-39% de los pacientes. Y para terminar de rematarlo, probablemente (incluso con un correcto diagnóstico), no le damos toda la importancia que deberíamos.
Vale, todo esto está muy bien, pero ¿cómo lo podemos diagnosticar, o al menos sospechar? Porque todo el mundo tiene claro que la biopsia hepática sería la prueba de elección, pero a nadie se le ocurre que sea una buena idea ir haciendo biopsias en el hígado de todos nuestros pacientes con psoriasis, ya que se trata de una exploración invasiva no exenta de riesgos. Por todo ello ha habido un interés creciente en los últimos años en conseguir métodos no invasivos y fiables. Las técnicas de imagen, como la ecografía, TAC o incluso resonancia magnética serían adecuadas, siendo la ecografía la que se lleva la palma por su accesibilidad, al menos como método de screening. Pero ni las analíticas ni las pruebas de imagen son capaces de diferenciar adecuadamente entre esteatosis y esteatohepatitis, ni permiten establecer ni descartar la presencia de fibrosis. Por eso se han desarrollado diferentes índices serológicos, siendo los más utilizados el HSI, el NAFLD fibrosis score o el FIB-4 score, que recogen datos como los valores de ALT, AST, IMC, la presencia de diabetes, edad, recuento plaquetario, edad o valores de albúmina, con unos valores bastante adecuados de sensibilidad y especificidad a la hora de detectar la presencia de fibrosis avanzada y, por tanto, seleccionar aquellos pacientes que se beneficiarían de pruebas más invasivas y/o un seguimiento más estrecho por el hepatólogo.
Y más allá de diagnosticar el HGNA en nuestros pacientes con psoriasis o al menos sospecharlo, ¿qué medidas terapéuticas podemos poner en marcha para evitar la progresión o minimizar ese riesgo? Pues aunque la ciencia avanza que es una barbaridad, lo cierto es que en el momento actual no disponemos de un tratamiento médico específico del hígado graso. Pero tenemos una buena noticia, ya que una pérdida de peso superior a un 7-10% y el ejercicio físico son los que van a permitir esa mejoría. Algo más fácil de decir que de conseguir que el paciente lleve a cabo, pero no por ello debemos desistir en el intento. Es igualmente importante evitar el consumo de alcohol, de grasas saturadas y de bebidas edulcoradas con fructosa. Y otra buena noticia: el café puede ayudar, siempre con moderación.
¿Y qué implicaciones terapétuticas puede tener todo esto en el tratamiento de la psoriasis? Sabemos que algunos fármacos sistémicos que empleamos para la psoriasis moderada-grave pueden producir una elevación de los lípidos o ser hepatotóxicos. Es el caso del metotrexato, ampliamente pautado en nuestros pacientes y que debería ser utilizado con mayor precaución en pacientes con HGNA. En cambio, parece haber muchos menos problemas con la acitretina (que puede provocar dislipemia y elevación de enzimas hepáticos). Ya si hablamos de biológicos, aunque los anti-TNF-alfa por su mecanismo de acción podrían mejorar esa inflamación que es la madre de todo el problema, en la práctica nos encontramos con que algunos pacientes experimentan un aumento de peso cuando se tratan con estos fármacos (lo que no ayuda) e incluso pueden producir (aunque no es muy frecuente) hepatotoxicidad. La toxicidad hepática con ustekinumab es mucho más rara y por su mecanismo de acción, la utilización de fármacos anti-IL17 parecen ser beneficiosos. Los anti-IL23 son más recientes y hay menos experiencia al respecto, pero no representarían un riesgo añadido. Tampoco parece haber problemas con apremilast.
En definitiva, debemos ser cautelosos y vigilar el hígado de nuestros pacientes con psoriasis, especialmente aquellos con enfermedad más grave que vayan a precisar tratamiento sistémico. Y siempre, siempre, siempre, aprovechar la ocasión para intentar mejorar los hábitos de vida de nuestros pacientes, que al final es lo que más les va a ayudar a disminuir su riesgo cardiovascular. Menos cervecita, y más zapatilla.
Con Emiliano al menos lo intentamos, sin demasiado éxito. Tenía una leve alteración de pruebas hepáticas y la ecografía era sugestiva de hígado graso, así que empezamos con ciclosporina A y después de unas cuantas tandas iniciamos tratamiento biológico con adalimumab, que de momento es eficaz y sin efectos adversos.
Hoy nos despedimos con un poco de música y un vídeo de Moby. ¡Hasta el sábado!
Moby - 'Why Does My Heart Feel So Bad?' (Reprise Version) Official Video from Steve Cutts on Vimeo.